SIFAT KOLIGATIF
Sifat Koligatif Larutan merupakan sifat dari suatu larutan yang hanya bergantung pada zat terlarut, bukan pelarut.
Hal hal yang dipengaruhi oleh Sifat koligatif larutan ini yaitu
perubahan titik beku, titik didih, tekanan uap dan tekanan osmotik.
Suatu larutan yang ditambahkan suatu zat terlarut akan mengalami
penurunan titik beku, kenaikan titik didih dan penurunan tekanan uap.
beberapa hal tersebut terlihat biasa saja namun sebenarnya sangat
penting dan sangat banyak manfaatnya. salah satu contohnya,
diaplikasikan pada air radiator. Etilen Glikol ditambahkan pada air di
radiator sehingga air tersebut yang seharusnya membeku pada suhu 0oC, masih dapat bertahan pada suhu dibawah 0oC dan menjaga agar mesin tetap dingin. Selain itu Larutan tersebut akan mendidih pada suhu yang lebih tinggi dari 100oC, maka mesin dapat bekerja pada suhu yang lebih tinggi dan optimal.
Yang kita lakukan disini ialah menghitung seberapa banyak Perubahan
yang terjadi pada sifat koligatif larutan bila suatu larutan ditambahkan
suatu zat terlarut
Penurunan Tekanan Uap
Sebelumnya apakah Anda sudah mengetahui tentang tekanan uap? Seperti
yang kita tahu, beberapa larutan akan menguap dan menghasilkan uap, pada
suatu saat uap tersebut akan mencapai kesetimbangan dengan larutannya.
maka Tekanan uap ialah tekanan suatu uap pada kesetimbangan dengan
dengan fasa non-uapnya.
Jika kita bandingkan suatu pelarut murni dengan larutannya yang telah
ditambah suatu zat nonvolatil. maka larutan tersebut akan mengalami
penurunan tekanan uap. Hal tersebut dijelaskan pada hukum Raoult, yaitu:
PA=XAPoA
PA= Tekanan uap Larutan
XA= Fraksi mol pelarut
PoA= Tekanan uap pelarut
Contoh Soal:
Tekanan uap air 17.5 torr , ditambahkan glukosa pada air sehingga XH2O=0,8 . Berapa tekanan uap Larutan?
Jawab : Plarutan=(0,8)(17,5)= 14 torr , jadi penambahan glukosa pada air akan menurunkan tekanannya sebesar 3,5 torr
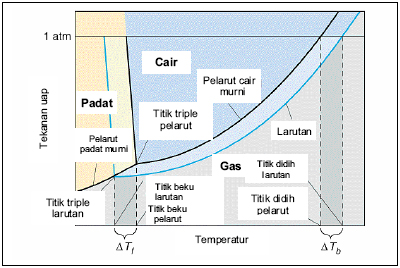
Kenaikan Titik Didih
Kenaikan titik didih sangat dipengaruhi adanya penurunan tekanan uap.
dari digram fasa diatas pun sudah terlihat bagaimana pengaruhnya, garis
biru yang jika ditarik dari garis hitam ke bawah merupakan berkurangnya
tekanan uap. pada pelarut murni, titik didihnya akan sama saat tekanan
uapnya 1 atm. Pada titik didih normal dari pelarut murni, tekanan uap
larutannya akan lebih kecil dari 1 atm. Maka untuk tekanan uap 1 atm,
akan di butuhkan titik didih yang lebih tinggi lagi.
Rumus yang digunakan untuk menghitung ini yaitu:
∆Tb=Kb m
∆Tb= Perubahan titik didih
Kb = konstanta kenaikan titik didih
m = Molalitas
Penurunan Titik Didih
Penurunan titik didih terjadi akibat penambahan zat terlarut pula, rumusnya yaitu:
∆Tf=Kf m
∆Tf= Perubahan titik beku
Kf= konstanta kenaikan titik beku
m = Molalitas
Tambahan bagi yang belum tau molalitas, molalitas adalah banyaknya mol zat dalam 1 Kg pelarut
Tekanan Osmosis
Osmosis sudah kita kenal melalui pelajaran biologi dimana banyak
terjadi pada sel. osmosis adalah berpindahnya pelarut dari larutan
berkonsentrasi rendah ke larutan berkonsentrasi tinggi. pada sistem
biologi, sudah kita pelajari bahwa pada osmosis biasanya pelarut
tersebut melalui suatu membran semi permeabel yang memungkinkannya untuk
memilih apa saja yang bisa dilewatinya.
Pada gas ideal kita mengenal PV= nRT
disini simbol tekanan osmosis ialah π
maka rumusnya : πV=nRT , jika V di pindah ruaskan maka n akan menjadi n/V yang merupakan Molaritas sehingga
π=MRT
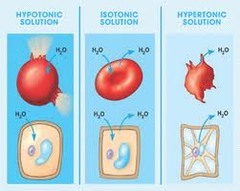
Jika 2 larutan yang memiliki tekanan osmosis sama dipisahkan dengan membran semipermeabel, maka tak akan terjadi osmosis.
Aplikasi dari pemahaman tekanan isotonik ini digunakan pada bidang
kedokteran dimana saat orang jatuh sakit dan memerlukan cairan tubuh
atau nutrisi yang tak bisa di konsumsi secara oral, maka larutan akan
diberikan melalui pembuluh darah. untuk mencegah terjadinya krenasi dan
hemolisis dari sel darah merah. maka larutannya haruslah isotonik dengan
dengan cairan di darah.